Il est l’élément le plus simple et le plus léger de la nature. Il est parmi les premiers à avoir été engendré par le Big Bang. Il est la principale source d’énergie des étoiles, et il est le plus abondant dans l’univers.
Pourtant, l’hydrogène est loin d’occuper la première place dans notre vie quotidienne si énergivore. Comment expliquer un tel paradoxe ? Bien-sûr, il n’y a pas vraiment de mystère autour de cet état de fait. Les énergies fossiles issues de la révolution industrielle ont aisément fait leur nid dans notre quotidien. Leur abondance, leur coût, et leur facilité de mise en oeuvre y sont pour quelque chose.
Mais aujourd’hui, alors que les conséquences de leur utilisation sont plus que jamais au devant de la scène, pourquoi continuent-elles à occuper la première place du podium ?
J’entends la réponse arriver : Les lobbies ! Certes, l’argent y est pour quelque chose, mais pas seulement. Si l’hydrogène est surtout un carburant de science-fiction à l’heure actuelle, les progrès scientifiques et les enjeux financiers pourraient bien provoquer, enfin, son arrivée dans notre vie quotidienne.
C’est quoi exactement de l’hydrogène ?
Il s’agit de l’élément le plus simple qui existe dans l’univers. Et pour cause, il n’est constitué que d’un seul électron gravitant autour d’un seul proton, ce qui en fait aussi l’élément le plus léger. On estime qu’environ 75% de la masse de la matière de l’univers est constituée d’hydrogène. Sa légèreté est telle, que la gravité terrestre ne suffit pas à le retenir dans notre atmosphère. Ainsi, l’hydrogène sous sa forme la plus simple, est extrêmement rare sur notre planète. De plus, il se combine rapidement avec d’autres éléments, ce qui augmente encore sa rareté à l’état naturel.
On parle de l’atome ou de la molécule ?
Mais il est couramment victime d’un abus de langage. Ce que nous appelons « hydrogène » dans la vie de tout les jours, se réfère en réalité à sa forme moléculaire, c’est à dire le « gaz hydrogène » qui est, en fait, du dihydrogène (de formule H2). Il s’agit donc de deux atomes d’hydrogène qui se sont combinés pour former du dihydrogène. C’est ce dernier que nous utilisions jadis dans les dirigeables, ou que nous brûlons dans les tuyères des fusées.
Et justement, lorsque nous « brûlons » du dihydrogène dans l’atmosphère, la molécule va se combiner avec les atomes d’oxygène et ainsi produire de l’eau (d’où son nom). En somme, lorsque nous utilisons du dihydrogène comme combustible, le seul gaz produit par cette réaction est de la vapeur d’eau. Difficile de faire plus écologique non ?
Où le trouve-t-on ?
Partout dans l’espace, la plupart des nébuleuses en sont gorgées, les étoiles l’utilisent comme matière première, bref, il n’est pas un endroit dans l’espace où l’hydrogène ne se trouve pas. Mais sur Terre c’est une autre histoire…

La nébuleuse de la tête de cheval, dans la constellation d’Orion, est un gigantesque nuage d’hydrogène.
(Crédit: Ken Crawford, Rancho Del Sol Observatory)
Il faut savoir que si l’hydrogène est très rare sous sa forme simple, il est en revanche très présent en tant qu’ingrédient d’autres molécules. Par exemple, les molécules organiques dont nous sommes constitués (environ 10% de la masse de notre corps est de l’hydrogène), et même les hydrocarbures que nous utilisons pour faire fonctionner nos moteurs diesels ou pour fabriquer des matières plastiques, contiennent de l’hydrogène.
Mais il y a un endroit sur Terre où l’hydrogène est plus présent que n’importe où ailleurs, l’Océan. Chaque molécule d’eau contient un atome d’oxygène et deux atomes d’hydrogène.
Est-il vraiment une énergie propre ?
Dans l’absolu, oui. Puisque sa combustion, en utilisant l’oxygène comme comburant, va produire de l’eau (sous forme de vapeur). Mais le problème est surtout que, comme expliqué plus haut, il est quasi introuvable sur Terre à l’état naturel. Il faut donc le « fabriquer ». Et c’est bien là qu’est le problème.

Usine de production d’hydrogène par reformage à la vapeur de Methane en Allemagne
(Credit: Air Liquide)
Fabriquer du dihydrogène consomme, comme tout processus industriel, de l’énergie (1). Or cette énergie peut provenir de différentes sources telles que le nucléaire, le gaz naturel, le pétrole ou le charbon. Le bilan carbone de la fabrication du dihydrogène serait donc loin d’être neutre dans ces conditions, et il parait difficile d’envisager de produire suffisamment de dihydrogène pour assumer la consommation du parc automobile mondial dans un futur proche. La transition serait donc longue.
On peut extraire le dihydrogène à partir de l’eau ou, étant donné qu’il entre dans la composition des molécules organiques, des hydrocarbures également. Mais il faut savoir que l’hydrogène est aussi parfois produit de façon « indésirable », notamment lors de la synthèse d’autres composés chimiques, sous forme d’un sous-produit du processus. De grands industriels(2) ont d’ores et déjà posé les premières pierre d’une filière de récupération de cet hydrogène à partir de gaz issus de processus industriels. Il s’agit là d’une démarche très positive si elle se concrétise dans les prochaines années.
Nous allons voir, dans cet article, le cas où l’eau serait utilisée comme matière première car les procédés de fabrication issus des hydrocarbure, notamment par vaporeformage, ne pourraient être considérés comme écologiques. A l’heure actuelle, il existe deux principales méthodes qui permettent de le produire de cette façon.
L’électrolyse
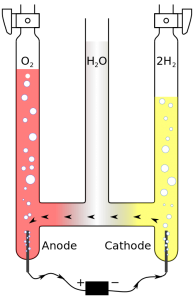
Principe du voltamètre de Hoffmann
(Credit: IIVQ)
Le principe de l’électrolyse est très largement connu, il s’agit du voltamètre de Hoffman. En soumettant un milieu aqueux à une tension électrique, il est possible de provoquer indirectement la séparation des atomes d’oxygène et de dihydrogène qui constituent la molécule d’eau. Pour favoriser la réaction, on ajoute des électrolytes à l’eau afin d’augmenter sa conductivité.
Le courant va « circuler » dans le milieu électrolytique par échange d’électrons entre les ions hydroxyde et les ions hydrogène. Les ions hydrogène (positifs) vont récupérer des électrons à la cathode pour retrouver leur équilibre de charge, tandis que les ions hydroxyde (négatifs) vont donner des électrons à l’anode. On observera alors un dégagement de dihydrogène sous forme gazeuse à la cathode (-) et d’oxygène gazeux à l’anode (+). La réaction produira deux fois plus de dihydrogène que d’oxygène selon la loi d’Avogadro.
Cette expérience peut être effectuée à la maison avec un matériel très simple, Internet regorge de tutoriels vous permettant de produire vous même votre dihydrogène (avec les précautions qui s’imposent) à des quantités très faibles.
Au niveau industriel, il s’agit exactement du même principe, si ce n’est que le procédé est évidemment optimisé à son maximum. Il faut noter que cette opération va consommer une certaine quantité d’énergie sous forme d’électricité, ce qui revient au problème cité plus haut quant à la source de cette électricité d’un point de vue écologique.
Il existe également un procédé similaire qui utilise un électrolyte gazeux (vapeur) porté à très haute température, il est à l’étude pour les centrale nucléaires notamment. Il permettrait un rendement supérieur grâce à l’utilisation de la chaleur de la centrale nucléaire afin de diminuer l’apport en énergie électrique, mais en reste au stade expérimental pour l’instant.
La séparation chimique
Ce procédé utilise les réactions chimiques de certains éléments afin de provoquer cette séparation de l’hydrogène. L’une des plus connue est celle du sodium et de l’eau. Cette expérience, courante dans les cours de physiques au collège, exploite la réaction chimique suivante:
→
Qui se traduit par:
Du sodium (Na) et de l’eau donne un ion sodium, de l’hydroxyde (OH) et du dihydrogène.
Autrement dit, de la soude et de l’hydrogène moléculaire. Cependant, la nature exothermique (qui génère de la chaleur) de la réaction provoque très facilement la détonation du dihydrogène ainsi produit. Cette réaction est donc dangereuse (ne tentez pas de le reproduire à la maison).

Alliage d’aluminium et de gallium utilisé pour la production de dihydrogène.
(Credit: Jerry M. Woodall)
Son application industrielle n’utilise toutefois pas de sodium (jugé coûteux et dangereux), mais exploite le même type de procédé. Le métal le plus rentable à utiliser et le plus facile à stocker et à manipuler est l’aluminium. La réaction, également exothermique, génère de l’hydroxyde d’aluminium et du dihydrogène, mais les conditions de températures sont beaucoup plus douces et permettent une récupération simple du dihydrogène. Il est cependant préférable d’utiliser un catalyseur afin d’optimiser la réaction et d’éviter que l’oxyde d’aluminium ne vienne la stopper en s’agglomérant. Le gallium et l’hydroxyde de sodium, par exemple, sont deux catalyseurs (parmi d’autres) qui ont été reconnus comme particulièrement efficaces pour une utilisation industrielle et qui ont fait l’objet de dépôts de brevets.
Ses applications actuelles

Test du moteur Vulcain de seconde génération.
(Crédit: ESA)
Celle qui nous intéresse le plus est, bien sûr, la conquête spatiale.
Les moteurs fusée utilisent principalement l’hydrogène comme carburant et l’oxygène comme comburant (3). A l’instar du moteur Vulcain utilisé par l’ESA sur les lanceurs Ariane 5 et 6 ou encore du moteur principal de la navette spatiale américaine (SSME). Cependant ils ne sont utilisés qu’en phase de propulsion spatiale et non au décollage, l’essentiel de la poussée étant généralement fournie par des boosters à poudre (excepté pour la lanceur Delta IV et son moteur RS-68).
Outre le monde de la propulsion spatiale, l’hydrogène est utilisé dans divers processus industriels tels que la fabrication de l’ammoniac, du méthanol, et de l’acide chlorhydrique. Il est également utilisé en tant qu’agent réducteur dans le traitement des minerais métalliques.

Tube fluorescent au tritum
Certains de ses isotopes sont aussi utilisés dans la filière du nucléaire. Notamment le deutérium, utilisé comme modérateur dans les centrales, et le tritium, utilisé pour booster le rendement des bombes atomiques ou comme source de radiation dans les tubes phosphorescents, les aiguilles des montres, ou encore sur les organes de visée des armes à feu.
Ses applications futures
Bien entendu, l’une de ses applications pourrait être l’automobile. Plusieurs prototypes existent déjà, qu’ils fonctionnent avec une pile à combustible ou directement en utilisant l’hydrogène comme carburant, ils sont fonctionnels et pourraient facilement se démocratiser. Certains constructeurs ont déjà tenté le pari, comme Toyota avec son modèle Mirai et Hyundai avec sa iX35. Le problème principal restant l’approvisionnement, la distribution et le coût du carburant.
Mais une autre utilisation prometteuse de l’hydrogène, ou plutôt de ses isotopes, serait la fusion nucléaire contrôlée.
En effet, le tritium ou le deutérium ont la particularité de fusionner avec plus de facilité. Raison pour laquelle ils sont utilisés dans les réactions initiales des explosions de bombes nucléaires.
Cette énergie permettrait de s’affranchir une fois pour toute de la fission et des carburants fossiles.
Peut-on prendre le risque de stocker de l’hydrogène chez soi ?
D’un point de vue strictement logique, il est difficile de se résoudre à posséder un réservoir rempli de gaz inflammable chez soi ou dans sa voiture. Cependant, c’est déjà le cas pour la plupart des ménages avec le butane domestique ou de chauffage, et même les citernes de fioul ou autres hydrocarbures. Depuis des années, nous stockons dans nos propres maisons des matières dangereuses et inflammables et nous avons acquis un savoir faire, concernant leurs conteneurs, qui permet de le faire dans de bonnes conditions de sécurité.
Mais pour l’hydrogène ce serait nouveau, nous ne disposons pas de recul sur la qualité ou les défauts des réservoirs d’hydrogène destinés au grand public. Il faut bien comprendre qu’un réservoir, pour une voiture par exemple, nécessiterait une pression de stockage de 350 à 700 bars afin de disposer d’une autonomie suffisante (5). Qu’arriverait-il si un tel réservoir venait à être endommagé lors d’un accident ?
A l’heure actuelle, la plupart des réservoirs de ce type sont construits à l’aide de matériaux composites renforcés par des fibres de carbone. Leurs protocoles de test sont très poussés et leurs résistance est le souci principal des industriels. Des essais ont été conduits avec des comparatifs assez intéressants par rapport à un véhicule essence (6).
Sur cette simulation, effectuée par l’université de Miami, on peut voir le résultat d’un incendie de réservoir entre un véhicule contenant de l’hydrogène et un véhicule similaire contenant de l’essence. Cette prise de vue a été effectuée une minute après le début de l’incendie.

Simulation comparative d’un incendie de réservoir, hydrogène à gauche, essence à droite une minute après le début de l’incendie.
(Crédit: Université de Miami – Département de l’énergie des USA)
A la vue de ces images et de ce compte rendu, la dangerosité de l’hydrogène embarqué peut sembler toute relative. Le véhicule à essence étant totalement la proie des flammes, tandis que celui qui contient de l’hydrogène ne montre qu’une flamme dirigée et ne se propageant pas au reste du véhicule. La totalité de l’hydrogène brûlant en quelques minutes, l’incendie ne durera pas.
Cependant, il existe également un moyen de stocker l’hydrogène de façon totalement sûre. Pour cela, il serait nécessaire de le stocker sous une forme non séparée. C’est à dire, de stocker les matériaux nécessaires à sa synthèse et d’effectuer la production de façon embarquée. Dans ce domaine, le professeur Jerry M. Woodall de l’université de Californie, mise sur l’utilisation de l’alliage aluminium – gallium qui serait donc « le carburant » stocké dans le réservoir et associé à un second réservoir qui ne contiendrait que de l’eau. L’hydrogène serait produit sur place, au sein même du véhicule, et à la demande, par projection d’eau sur des blocs de cet alliage. Ainsi le stockage se limiterait à des blocs d’aluminium totalement inertes.
Conclusion
Compte tenu de ce que nous avons vu dans cet article, il est difficile de nier le potentiel énorme de cet élément primordial, pourtant maintenu à l’écart des progrès scientifiques durant tant d’années. Cependant, il est aussi difficile de nier l’intérêt que certaines multinationales commencent à lui montrer avec des investissements de plusieurs millions de dollars à la clé.
 L’enjeu de la fusion nucléaire, de la pile à combustible, et de la production en masse d’hydrogène est économiquement énorme. Il est plus que temps que les leaders de l’énergie relèvent le défi de rendre cet élément disponible pour tout un chacun, et je ne doute pas qu’ils y pensent sérieusement.
L’enjeu de la fusion nucléaire, de la pile à combustible, et de la production en masse d’hydrogène est économiquement énorme. Il est plus que temps que les leaders de l’énergie relèvent le défi de rendre cet élément disponible pour tout un chacun, et je ne doute pas qu’ils y pensent sérieusement.
Mais le défi est de taille, il faudrait pour cela revoir la totalité du circuit de distribution de carburant, équiper bon nombre de centrales nucléaires de systèmes d’électrolyse à haute température, mettre en place des dispositifs de récupération et de stockage des sous-produits riches en dihydrogène, bref… Revoir la quasi-totalité de notre industrie et prévoir le remisage, le recyclage ou la transformation des anciens équipements.
Etant donné l’état actuel de notre monde, il y a fort à parier que ce changement prendra des années et qu’il concernera non pas nos enfants, mais des générations plus jeunes encore. Nous en verrons les prémices, je l’espère, et nous verrons certains de ces changements. Je ne voudrais pas être trop optimiste, mais je pense réellement qu’un jour il n’y aura pas d’autre source d’énergie plus naturelle dans l’univers, même sur Terre.
Sources
- La tribune: Air Liquide pose la première pierre d’une filière hydrogène française
- Capcom Espace: CSG, la production de carburant
- Institut National de l’Environnement Industriel et des Risques (PDF)
- WH2 : La transition énergétique par l’hydrogène et les piles à combustible
- Rapport de l’université de Miami sur une simulation de fuite de carburant (PDF)















